L’elettroforesi su gel di agarosio in tampone neutro SDS consente di separare ed evidenziare le proteine urinarie secondo il loro peso molecolare annullando le differenze di carica. Al termine della migrazione si otterranno quindi bande elettroforetiche formate da proteine omogenee per dimensione. In relazione al peso molecolare delle proteine presenti nel campione, la proteinuria potrà essere classificata permettendo quindi di distinguere facilmente le proteine di origine tubulare da quelle di origine glomerulare. I quadri elettroforetici risultanti, sono comparati visivamente ai pesi molecolari delle proteine evidenziate nella lane di riferimento, al fine di identificare le singole proteine urinarie e quindi classificare appunto il tipo di proteinuria.
Il livello minimo rilevabile attualmente è di circa 15 mg/l per frazione.
Raccolta e conservazione del campione
L’analisi è eseguita su campioni di urine freschi, raccolti nelle 24 ore. Se necessario è possibile conservare le urine a 2 – 8 °C per un massimo di una settimana.
Interpretazione
L’interpretazione è di tipo qualitativa. Come aiuto nell’interpretazione vedi la BIBLIOGRAFIA.
Quadro di riferimento migrazione
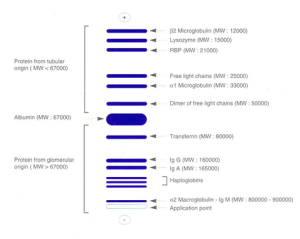
Proteinuria fisiologica
E’ debole, di solito la proteina maggiore è l’albumina, associata con tracce di transferrina ed immunoglobuline.
Proteinuria patologica
Una proteinuria con rapporto proteinuria/cretinuria superiore a 0,4 deve essere considerata come patologica e deve essere seguita da una analisi qualitativa delle proteine eliminate.
Proteinuria glomerulare: trattasi di una proteinuria ad alto peso molecolare (> 67.000 D), secondaria ad una disfunzione della barriera di filtrazione glomerulare.
Si distinguono due forme di proteinuria glomerulare rispettivamente selettiva e non selettiva.
La forma selettiva caratterizza una lesione glomerulare precoce e reversibile con perdita di albumina (P.M. 67.000 D) e transferrina (P.M. 80.000).
La forma non selettiva è indicativa di una lesione avanzata della membrana basale con perdita della funzione di setaccio glomerulare; tipico è il riscontro di IgG (P.M.160.000 D).
Proteinuria tubulare: trattasi di una proteinuria a basso peso molecolare (< 67.000 D) espressione di un mancato riassorbimento proteico da parte del tubulo contorto prossimale. Frequente è il rilievo di β2 microglobulina (P.M. 12.000), lisozima (P.M. 15.000) e RPB (retinol binding protein, P.M. 12.000), catene leggere libere monoclonali o policlonali.
Proteinuria mista: coespressione di una proteinuria glomerulare e tubulare.
BIBLIOGRAFIA
Cameron JS. 1987. The nephrotic syndrome. Am J Kidney Dis, 10 : 157-171.
Chopin N. 1991. Étude de la protéinurie. Inf Tech Biol, 1 : 23-28.
Cohen R, François B, Sabot JF, Bernard P, Picq JP, Adeleine P. Étude comparative de l’immunoélectrophorèse urinaire et de quatre index de sélectivité glomérulaire au cours des glomérulopathies chroniques. 1985. Path Biol, 33 : 23-26.
Joachim GR, Cameron JS, Chwartz M, Belker EL. 1964. Selectivity of protein excretion in patients with the nephrotic syndrome. J Clin Invest,43, 2332-2346.
Laemli U.K., Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227 : 680-685.
Le Bricon T, Erlich D, Bengoufa D, Dussaucy M, Garnier JP, Bousquet B. 1998. SDS-agarose gel electrophoresis of urinary proteins : Application to multiple myeloma. Clin Chem., 44 : 1991-1997.
Le Carrer D. 1990. Protéinuries : Mise au point sur leur exploration biologique en 1990. L’Eurobiologiste, 190 : 395-405.
Le Carrer D, Chopin N. 1994. Profil protéique urinaire : Proposition d’un protocole d’exploration biologique des protéinuries. Revue française des laboratoires, 269 : 29-37.
Le Carrer D, Nicolas A, Ducasse L. 1992. L’analyse des protéinuries au laboratoire de biologie en 1992. Revue française des laboratoires, 225 : 41-47.
Linstedt G, Lindberg PA. 1974. Loss of tubular proteinuria pattern during urine concentration with a commercial membrane filter cell. Clin Chem Acta, 56 : 125-126.
Philipon C. 1989. Protéines urinaires : Intérêt clinique et interprétation. Technique et Biologie, 6 : 239-249.
Waller KV, Ward KM, Mahan JD, Wismatt DK. 1989. Current concepts in proteinuria. Clin Chem, 35 : 755-765.
Westermeier R., «Electrophoresis in Practice. A Guide to Theory and Practice», VCH Publishers, New York, NY, 1993.